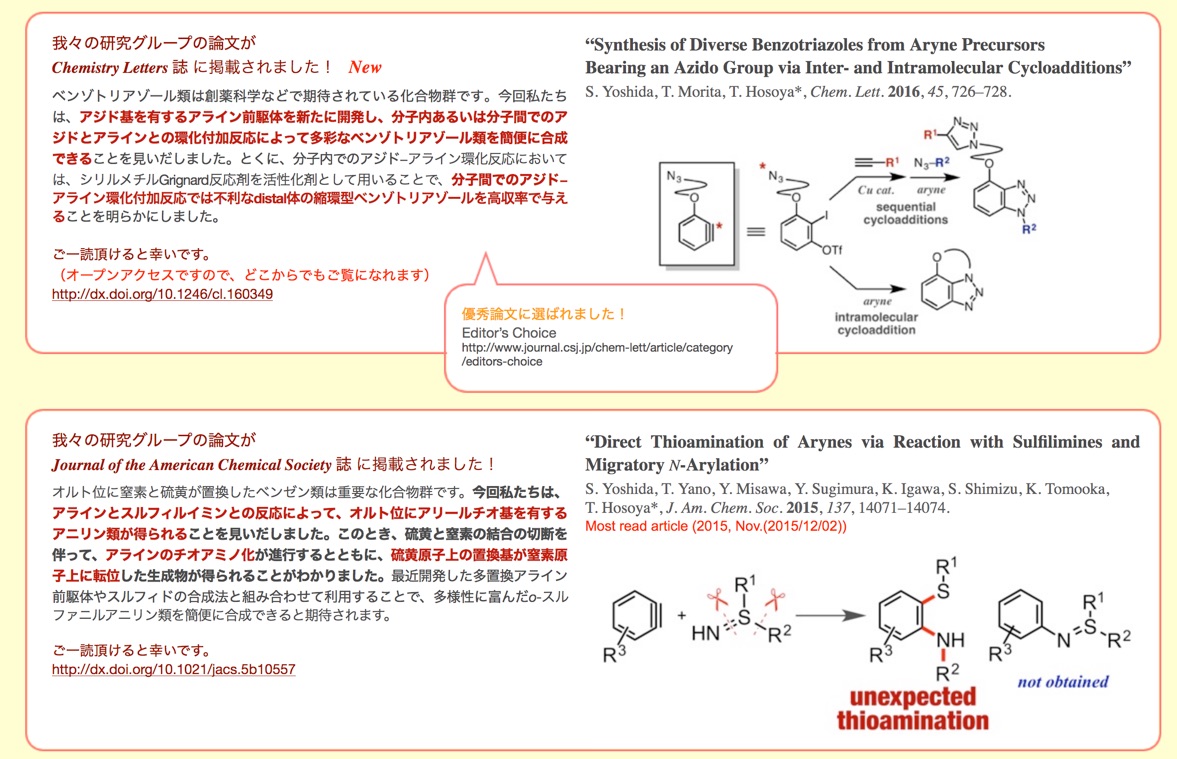
我々の研究グループの論文が
Chemistry Letters 誌 に掲載されました! New
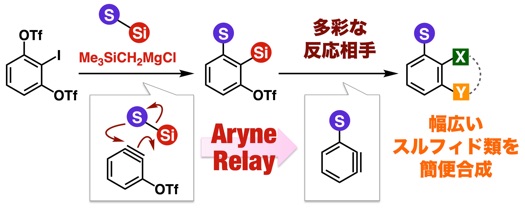
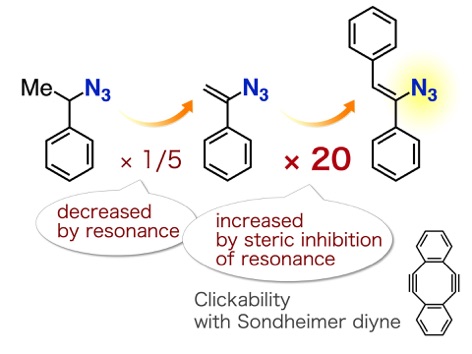
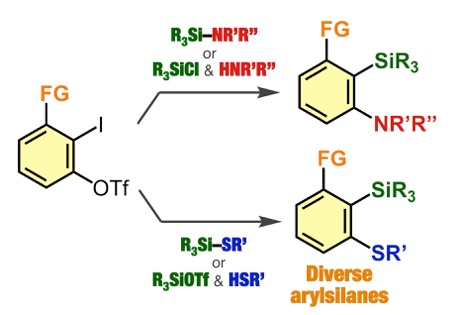
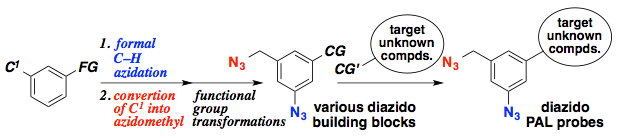
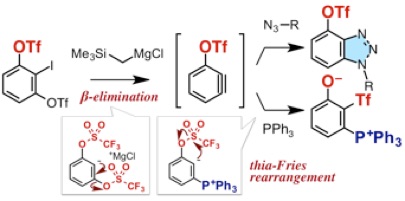
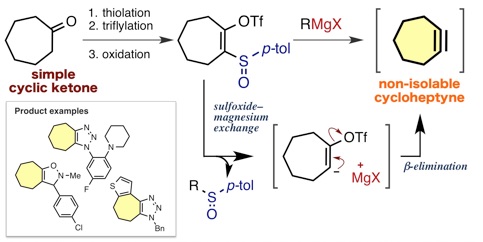
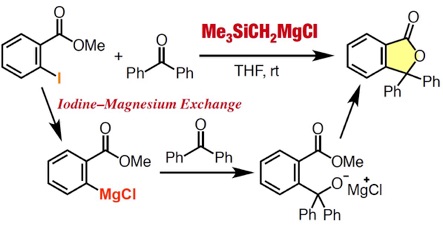
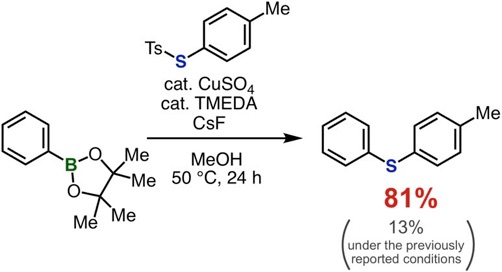
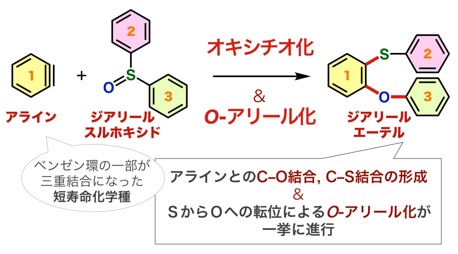
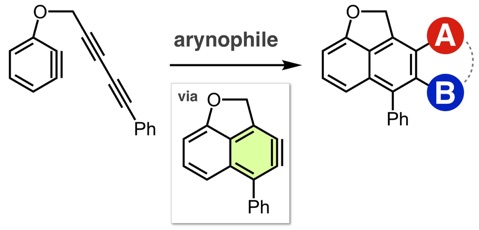
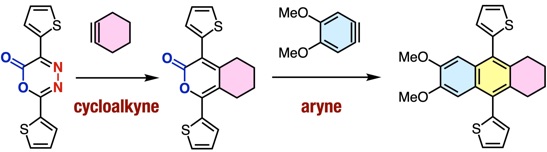
アントラセン類をはじめとする、複数の環が縮環した芳香族化合物は、創薬科学や材料化学において注目されている化合物群です。今回、我々は、オキサジアジノンをプラットフォームとして用いて、環状アルキンおよびアラインとの2度の反応を制御して行うモジュラー合成法の開発に成功しました。具体的には、オキサジアジノンがシクロヘキシンやシクロオクチンなどの環状アルキンと効率よく反応することを明らかにしました。次に、生じたピロンがアラインと効率よく反応し、2つの環と縮環したベンゼン類を合成することに成功しました。さらに、本手法によって一部が飽和になったアントラセン類縁体をモジュラー合成できることも明らかになりました。今後、従来法では合成の容易ではないアントラセン類縁体を、本手法によって系統的に合成できることから、アントラセン類を用いる合成化学の発展に役立つと期待されます。
ご一読頂けると幸いです。
(オープンアクセスですので、どこからでもご覧になれます)
https://doi.org/10.1246/cl.190118
我々の研究とう同時期にGargらのグループからも類似の成果が報告されました。
E. R. Darzi, J. S. Barber, N. K. Garg, Angew. Chem., Int. Ed. 2019, in press.